№ 2 (20) / 2025 
Артем Афанасьев,
учащийся КГБУ ДО «АКЦДОТиК «Алтай», г. Барнаул

Е.Г. Кашкарова,
руководитель Клуба «Юный геолог», г. Барнаул
Окружающий нас мир состоит из кристаллов, можно сказать, что мы живем в мире кристаллов. Выращивание кристаллов в наше время очень интересная и актуальная тема, потому что и природные, и искусственные кристаллы широко применяются в разных областях нашей жизни: ювелирная промышленность, медицина, радиотехника, ма шиностроение и т. д.
Выращивание кристаллов в домашних условиях всегда остается увлекательным, познавательным и интересным занятием.
Цель работы: вырастить друзу кристаллов хлорида никеля заданной формы.
Никель – элемент десятой группы четвертого периода периодической системы химических элементов Д.И. Менделеева с атомным номером 28. Обозначается символом Ni (лат. Niccolum). Простое вещество никель – это пластичный, ковкий, переходный металл серебристобелого цвета, при обычных температурах на воздухе покрывается тонкой пленкой оксида.
Неорганические соединения никеля: оксиды, гидроксиды, соли.
Важнейшие растворимые соли никеля – ацетат, хлорид, нитрат и сульфат. Водные растворы солей окрашены обычно в зеленый цвет, а безводные соли – желтые или коричнево-желтые.
При умеренном прокаливании на воздухе NiCl2 переходит в окись никеля (II) (моноокись никеля). Он легкорастворим в воде и в спирте (в 100 г воды при 20°С растворяется 64,0 г, а при 60°С – 81,2 г NiCl2) (рис. 1). Из светло-зеленого водного раствора он кристаллизуется с водой обычно в виде гексагидрата NiСl2*6Н2O – травянисто-зеленых зернистых кристаллов в форме моноклинных призм. При выдерживании над концентрированной серной кислотой гексагидрат постепенно переходит в дигидрат. Известен также моногидрат. С щелочными и другими хлоридами хлорид никеля образует двойные соли (хлорникелаты), например, 4Cl*NiCl2*6H2O – зеленые ромбические призмы.
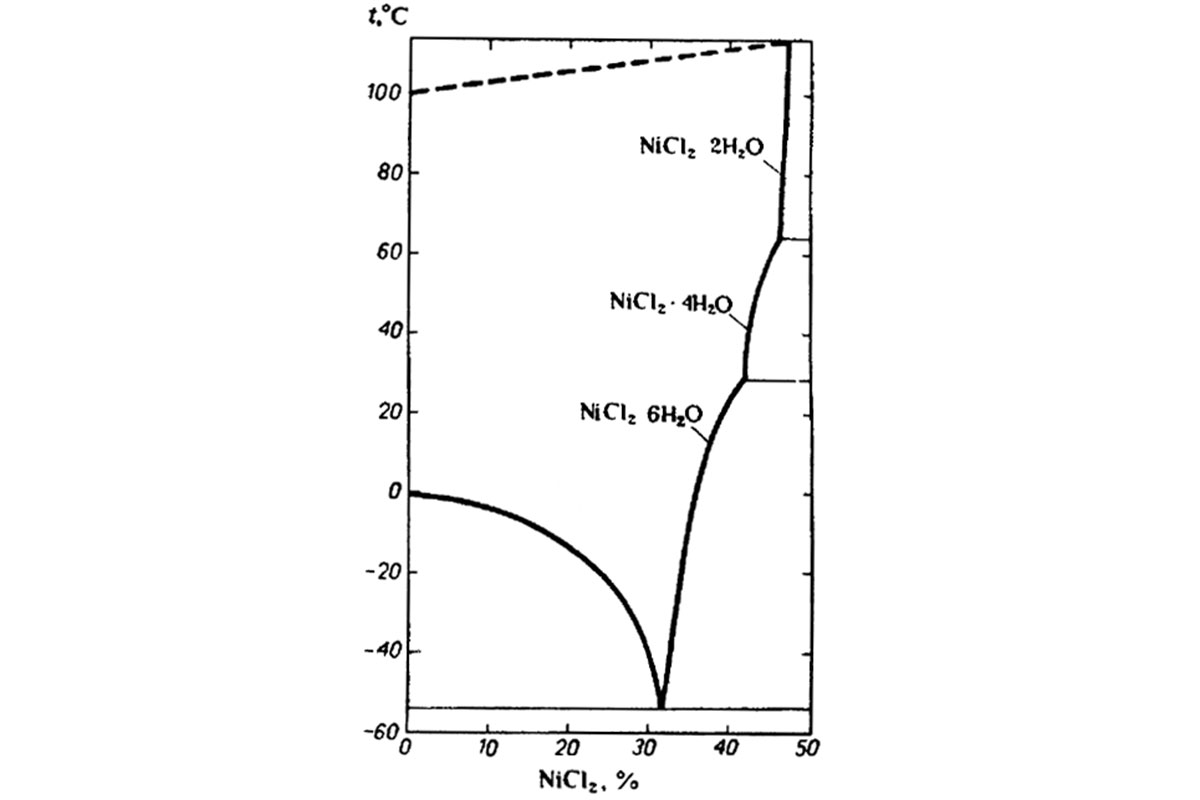 Рис. 1. Зависимость растворимости соли NiCl2 от температуры. (Киргинцев и др., 1972)
Рис. 1. Зависимость растворимости соли NiCl2 от температуры. (Киргинцев и др., 1972)
Кристаллы (от греч. krystallos, первонач. – лед) – твердые тела, атомы или молекулы которых образуют упорядоченную периодическую структуру (кристаллическую решетку).
Кристаллизация – это процесс образования кристаллов. Начинается она лишь при определенной концентрации вещества в растворе при наличии очага кристаллизации. Выращивание кристаллов – физикохимический процесс. Количество вещества, которое может раствориться в 100 граммах воды, называется растворимостью этого вещества в воде; например, растворимость поваренной соли в воде при комнатной температуре равна 35 граммам. Растворимость зависит от температуры. У разных веществ растворимость поразному зависит от температуры.
При каждой определенной температуре в воде может раствориться лишь строго ограниченное количество вещества, определяемое его растворимостью.
Раствор, который больше не может поглотить ни крупинки вещества, называется насыщенным. При высокой температуре раствор был насыщенным, а остыв, он стал перенасыщенным. Такой перенасыщенный раствор не может долго существовать, поэтому лишнее вещество выделяется из раствора и оседает на дно стакана.
Растворенное вещество кристаллизуется из перенасыщенных растворов потому, что его оказывается в растворе слишком много – больше, чем раствор может удержать в себе.
Для выращивания кристаллов из соли в домашних условиях необходимо соблюдать определенный алгоритм:
1) приготовить насыщенный раствор;
2) изготовить затравку;
3) привязать затравку к нитке и опустить в колбу с насыщенным раствором. Затем поставить емкость с раствором и затравкой в место с постоянной температурой;
4) дождаться роста кристалла;
5) когда кристалл достигнет нужного размера, вытащить и высушить его.
Кристаллизация – процесс длительный, занимающий от нескольких дней до 1 месяца.
Итак, для получения моей друзы кристаллов конической формы 6-водного хлорида никеля я 14.11.2024 г. изготовил раствор.
Для приготовления маточного раствора я взял чистый, хорошо вымытый термостойкий стакан. В него влил дистиллированную воду (200 мл). В стакан засыпал вещество (соли хлорида никеля) небольшими порциями (130 г) и нагрел до 40°С, каждый раз перемешивая и добиваясь полного растворения (рис. 2).
 Рис. 2. Приготовление раствора (фото Кашкаровой Е.Г.)
Рис. 2. Приготовление раствора (фото Кашкаровой Е.Г.)
Далее я оставил раствор при комнатной температуре на сутки. Чтобы в раствор не попала пыль, его накрыл листом фильтровальной бумаги и оставил в той части помещения, где сохраняется постоянная температура +20°C, где в дальнейшем будет продолжаться опыт.
На следующий день осмотрел раствор, осадок не выпал, поэтому я добавил в него еще 25 г хлорида никеля, подогрел раствор, постепенно размешивая, снова накрыл и убрал на прежнее место.
Осадок не выпадал в течение 15 дней, поэтому каждые 3 дня приходилось подсыпать в раствор хлорид никеля в количестве 25 г.
Наконец 01.12.2024 г. осадок выпал, значит, раствор «насытился». Всего на 200 мл воды израсходовали 280 г соли. Готовый очищенный раствор я аккуратно слил с осадка кристаллов в термостойкий стакан.
Из оставшихся на дне кристалликов отобрал подходящий сросток с длинной стороны 0,5 см. Это и есть затравка. С ней я буду продолжать эксперимент (рис. 3).
 Рис. 3. Затравка (фото Афанасьева А.)
Рис. 3. Затравка (фото Афанасьева А.)
Эта стадия эксперимента является исходным кирпичиком для получения огромной конструкции.
Друзу кристаллов выращивают из полученной затравки. Используя леску, плотно на 2 раза обвил затравку, чтобы она не соскользнула. Второй конец лески примотал к крестовине из деревянных палочек, чья длина больше диаметра стакана.
Снова приготовил насыщенный раствор на основе исходного маточного. Для этого просто нагрел насыщенный раствор до 40°C, без добавления вещества. Грел и перемешивал. Стакан с раствором установил на выбранное место и дал постоять 30 минут, чтобы жидкость немного успокоилась. Наш раствор не перенасыщенный, поэтому «лишние градусы» могут вызвать растворение затравки, что нам не нужно.
Следить за остыванием раствора следует очень внимательно, чтобы не допустить ее понижения до комнатной. Затем расположил затравку в теплом растворе (температура на пару градусов выше комнатной) таким образом, что бы кристаллик как бы висел в нем, на высоте 1/2 от дна. Поместив затравку в раствор, осталось только ждать, при этом вертеть, наклонять стакан, перемешивать раствор нельзя.
Ежедневно я следил за изменениями, происходившими с затравкой. Вначале я увидел, как система «обживала» затравку. По мере роста леска начала уходить внутрь кристалла, получилось что-то вроде кулона (рис. 4).
 Рис. 4. Друза кристаллов через 3 дня (фото Афанасьева А.)
Рис. 4. Друза кристаллов через 3 дня (фото Афанасьева А.)
В процессе выращивания друзы кристаллов у меня снижалось количество раствора за счет его испарения, соответственно, выросшая в растворе верхняя часть обнажалась и прекращала расти, а в нижней части рост про должался.
08.12.2024 на сростке появился «паразит», который пришлось отсечь, чтобы в дальнейшем получить заданную коническую форму, вес сростка составлял 0,98 грамма (рис. 5).
 Рис. 5. Сросток кристаллов с наросшими вдоль лески «паразитами» (фото Афанасьева А.)
Рис. 5. Сросток кристаллов с наросшими вдоль лески «паразитами» (фото Афанасьева А.)
15.12.2024 вес – 7,08 грамма.
Раствор постепенно испарялся, и форма друзы кристалла становилась конической.
22.12.2024 мы добились желаемого результата: к Новому году у нас выросла красивая зеленая кристаллическая ель весом 33 г, высота – 5 см, диаметр по низу – 34 мм, по верху – 6 мм (рис. 6).
 Рис. 6. Друза кристаллов конической формы 6-водного хлорида никеля (фото Афанасьева А.)
Рис. 6. Друза кристаллов конической формы 6-водного хлорида никеля (фото Афанасьева А.)
Также на рисунке 6 можно видеть, что все крупные кристаллы на нижней части «елки» сдвойникованные. Двойники – закономерное срастание кристаллических индивидов одного минерала, связанных друг с другом осью или плоскостью симметрии. Двойникование обычно происходит на ранних этапах кристаллизации (рис. 7).
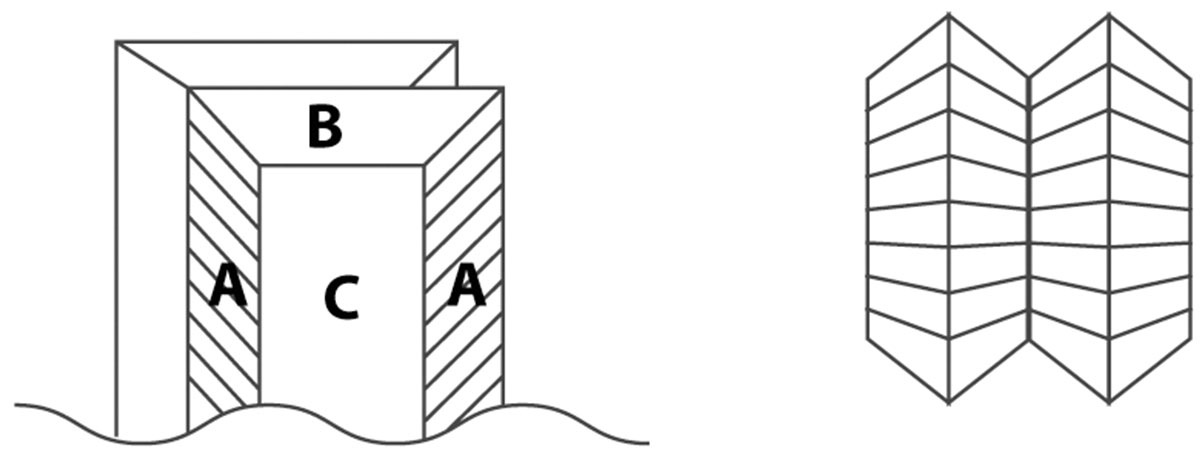 Рис. 7. Кристалл-двойник. Вид спереди (слева) и вид сверху (справа). (А, В – ромбическая призма, С – пинакоид) (автор Афанасьев А.)
Рис. 7. Кристалл-двойник. Вид спереди (слева) и вид сверху (справа). (А, В – ромбическая призма, С – пинакоид) (автор Афанасьев А.)
Таким образом, проведенный опыт подтвердил, что:
• искусственное выращивание кристаллов возможно и в домашних условиях;
• ростом кристаллов можно управлять;
• крупные кристаллы оказались сдвойникованы, т. к. имели преимущество в росте и обогнали своих одиночных собратьев.
Работа над проектом оказалась для меня очень интересной и познавательной.
Так как этап выращивания кристаллов оказался самым трудоемким, мне приходилось на протяжении 2 месяцев работать в лаборатории для того, чтобы сменить растворы, приготовить новые, зафотографировать, записать изменения.
Цель достигнута. Друза кристаллов хлорида никеля выросла заданной конической формы.
Эксперимент показал, что формой друзы можно управлять и получать нужные размеры и формы. Также я узнал, что такое двойники и чем они отличаются от одиночных кристаллов.
Список литературы
1. Верховский В.Н. «Техника и методика химического эксперимента в школе», Л.: УЧПЕДГКЗ, 1 том, 2000 г.
2. Киргинцев А.Н., Трушникова Л.Н., Лаврентьева В.Г. Рас творимость неорганических веществ в воде. Справочник. Из-дво «Химия», Л., 1972, стр. 248, таб. 87, рис. 589.
3. Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др. – М.: Советская энциклопедия, 1992. – Т. 3 (Мед-Пол). – 639 с. – ISBN 5822700398.
4. ru.wikipedia.org; (20.01.2025).



